Augmented fluoroscopy [新しいNavigation toolとして活躍するか?]
比較的新しく出てきたNavigation systemとしてのAugmented fluoroscopy.簡単に説明すると,CT dataから作成された末梢結節の位置とそれに到達するまでの道のりを透視画像に投影できるという技術.簡単に説明してしまうとこれだけだが,これには様々な技術が盛り込まれている.

↑Cited from BODYVISION homepage (https://bodyvisionmedical.com/)
末梢結節などの肺野の一点をターゲットとして3D構築して透視画像に載せる技術はCone-beam CTのソフトウェアとして備わっているが,このAugmented fluoroscopyは呼吸に合わせた結節位置やルートを特定のアルゴリズムを用いてあたかも同期しているように映すことができる.とりあえず今の時点でFDA認可を受けているのはLungVisionしかないが,これは患者の背中側にRadiopaque beadsのついたボードを置いてRegistrationに用いている.
今年は何本か論文がでている
J Bronchology Interv Pulmonol. 2020 Jul 8. doi: 10.1097/LBR.0000000000000697. Online ahead of print. Cone-Beam CT Image Guidance With and Without Electromagnetic Navigation Bronchoscopy for Biopsy of Peripheral Pulmonary Lesions
J Bronchology Interv Pulmonol. 2020 Jul 24. doi: 10.1097/LBR.0000000000000700. Online ahead of print. Prospective Analysis of a Novel Endobronchial Augmented Fluoroscopic Navigation System for Diagnosis of Peripheral Pulmonary Lesions
J Bronchology Interv Pulmonol. 2020 Oct 23. doi: 10.1097/LBR.0000000000000722. Online ahead of print. Augmented Fluoroscopy: A New and Novel Navigation Platform for Peripheral Bronchoscopy
特に設定が面白いのが1番目の論文で,Augmented fluoroscopyにElectromagnetic navigation を加えると診断率が上がりますよというもの.それぞれの技術が補填しあって,Multi-modalityにするのがいいですよ,という論旨.たしかにそうだが,CBCTで最後に場所も特定して,と医療資源的にあらゆる症例にできるような組み合わせとは言えないだろう.
考察.
AFは何のためのものか.これはNavigation toolです.間違ったルートに入っていっていないかがわかる.Targetへのルートを選べて,かつ透視で見えないようなTargetの位置も同定できる.ときおり出くわす難しい症例は,枝が選びにくくて,かつTarget到達までに素直な走行をしない気管支.この場合いくらスコープで見えている範囲で気管支を正しく選択したとしてもその先の末梢のルートを選ぶのに苦慮する.何度もR-EBUSを出し入れしてTargetに近づく枝を透視画像を参考に探すという症例.このような難しい症例では,AFは役立つかもしれない.AFで投影された他の気管支の走向を参考にして,正しい気管支に入っていないことに気付ける.また透視で見えないGGNのような場合,基本的にEBUS画像も分かりづらい.Blizzard signを探すが,それでもわかりづらい.GGNでかつ横隔膜や心臓に隠れるような位置に存在すると難関.そういうときにはTarget位置が投影されてわかっているのは参考になる.
しかし,あえて批判的に見てみる.上記のような症例はどのくらいあるだろうか? 多くの症例は可能な限りTargetに近づけるスコープで『正確に枝を選べば』,素直に到達でき,R-EBUSで確認できる結節ばかり.ごく一部の,透視で視認できなくて,かつ枝の走向がひねくれているTargetに限定して,効果が発揮されるツールのような気がする.そういう結節がどのくらいの割合なのかは施設によって異なるだろう.
とはいえ,重要なポイント『正確に枝を選べば』,ということ.これはほかでも何度も議論しているが,枝読みが得意で正確に挿入気管支を選べる日本の気管支鏡医はわりと簡単にできてしまう.今回のAFも,VBNもENBもそうだが,Targetまでの枝読みが完璧であれば,威力をそこまで発揮しない.なぜならこれらはNavigation toolだから.枝読みに自信がない,という気管支鏡医には強い味方になるだろう.
ここからは今回の話題としては蛇足かもしれないが,重要なので繰り返し言いたい.NavigationとConfirmationは違う.Targetまでの道案内と,ここがゴールですよと教えてくれることは別物であり,それぞれ独立して重要なこと.このAFを使ったとしてもConfirmationはできない.ConfirmationはR-EBUSやCone-beam CTで行われるが,これは枝読みがいくらできていても代替できないmodalityである.かと言って,今我々が使えるConfirmation toolも完璧ではない.なぜならこれだけではReal-time biopsyにつながっていないからである.R-EBUSでConfirmしてもそのあと生検デバイスを挿入するためにR-EBUSは抜かないといけない.経験の浅い気管支鏡医がやると,R-EBUSでConfirmしても,Biopsyしているとずれてくることがある.これでは小さなTargetを正しくSamplingすることはできない.今のところ,末梢結節に対してReal-time biopsyを行えるデバイスは商品化されていないが.リンパ節に対するConvex EBUSがあれだけの高い診断率を出せるのはReal-timeだからだ(採取するところをReal-timeに見ている).
話が横道にそれたが,今回は比較的新しいAFの技術について紹介した.これからエビデンスが蓄積されてくる分野だが,その効果が発揮される結節はどのようなものかということを少し考えるべきと思う.

新しい明日へ!
硬性鏡によるステント留置の際の麻酔方法 [自発呼吸よりも筋弛緩下調整換気]
今回とりあげる論文は,
Anesth Analg. 2020;131(3):893-900.doi: 10.1213/ANE.0000000000004544.
A Prospective, Randomized Trial Comparing Respiratory Status During Anesthesia for Airway Stenting: Spontaneous Respiration Versus Controlled Ventilation With Muscle Relaxants
前向きRCTによる,自発呼吸VS筋弛緩薬併用調整換気
名古屋医療センターからの報告.さすがという感じです.
自発呼吸群(SP群):Induction with Propofol TCI at 1.0 mg/mL and remifentanil at 0.1 mg/kg/min. FiO2 1.0
筋弛緩薬併用調整換気群(MR群):Induction with Propofol TCI at 3.0 mg/mL and remifentanil at 0.5 mg/kg/min, + Rocuroniumu at 0.6 mg/kg, Pressure-limited controlled ventilation, FiO2 1.0
Primary endpoint: SpO2 95%未満になるイベント数
結果:SpO2 95%未満のイベント,SP群 24/32 75% VS MR群 3/31 9.7% (P<0.001)
平均の狭窄度はSP群74.5%,MR群76.4%.施行時間:SP群76.3±47.0 min VS MR群58.8±30.7 min.
硬性鏡の麻酔方法は施設に依存する形だと思いますが,それでいてきちんとRCT試験を組んで結果を出すというのが素晴らしいですね.手技に関連した低酸素イベントはその狭窄度やインターベンションの難易度にも大きく影響を受けるので,完全にランダム化というのは難しいにせよ,狭窄度の平均はそこまで乖離はないようです.明らかな有意差をもって筋弛緩薬併用調整換気群がSpO2 95%未満への低下が少なかったということになります.低酸素イベントの定義をSpO2 95%で区切った理由も本文中に述べられていますが,特に気管の狭窄では急落することがあるので早めにアクションを起こすというのは賛同します.個々のデータは示されていないですが,SP群のSpO2の最低値の平均が92%程度であり,FiO2 1.0で換気していてもなおインターベンションではそれくらい下がるということですね.(一方MR群の最低SpO2平均は97.7%)
一方で,中枢気道に極めて高度な狭窄をきたしている場合には,自発呼吸を止めることで陽圧換気で入らなくなることもあるという話は聞いたことがあります.あくまで狭窄度75%前後の狭窄に対して気管ステント留置した際のデータであることには留意すべきだと思います.

新しい明日へ!
末梢肺GGO診断に対するUltrathin cryoprobe

Transl Lung Cancer Res. 2020 Oct;9(5):1963-1973. doi: 10.21037/tlcr-20-957.
Shanghai Chest Hospitalから.
Cryoprobeによる末梢診断,とくにGGN(Ground glass nodule)にしぼったCase seriesです.ご存知の通りCryoprobeが気管支鏡に導入されて間質性肺疾患の診断が変わろうとしています.末梢肺結節の診断に適用しようというのは自然な流れで,そのためには従来の大きさではアクセス性および安全性の面で懸念されることがあったわけです.そこでさらに細いProbeを使用していこうという意図で開発されています.貴重なエビデンスのひとつです.
 Referenced from doi: 10.21037/tlcr-20-957.
Referenced from doi: 10.21037/tlcr-20-957.
1.1mmの細さ.これはしびれますね.どの気管支鏡にもfitします.
論文内では取れた際の検体のマクロ像は示されてはいませんが,病理像のFigureを見るとさすがCryoprobeという病理像です.論文のFigureなのでChampion figureを持ってきているというバイアスを加味しても,GGNから採取してきた病理像としては秀逸.
Case series中,23のGGO.うち12がPure GGO.大きさは平均21.6mm.22のターゲットでEBUS-GS法でアプローチしていて,ENB併用が9個,VBN併用が14個(いまいちENBとEBUS-GSをどのように併用したのか記載がなく不明...).すべての結節はBronchus sign陽性.
うち21の結節(91.3%)でサンプル採取できて,19(82.6%)で診断がついた.そのうち悪性以外の診断を7結節含む.悪性以外のGGOもこれだけ診断できるのはかなり良い結果だと思います.
少し議論を進めます.肺野末梢GGNに対する経気管支アプローチによる診断率はどれくらいでしょうか.既報Ann Thorac Med. 2017;12(3):171-176. doi: 10.4103/atm.ATM_428_16. を引用しますが,GGN254例を後ろ向きに調べた解析で(GGNでこのnはすごい!),EBUS-GS+VBN+Fluoroscopyを併用しています.その診断率は65.7%でした.65%でも実臨床の経験として,高めかなというくらいの感覚です.それが今回とりあげたStudyではnは限定的ですが,82.6%の診断率.Bronchus signが全例陽性ということを考えても高いと言えます.
GGNの多くは,Fluoroscopyで見えないか見えてもよくわからないものが多いです.GGNのEBUS画像はBlizzard signという特徴的な像を示すことで知られていますが,しかし,ひとたび採取を始めてしまうとBlizzard signは認識できなくなってしまうので,EBUSでBlizzard signを見たらその場所を絶対に動いてはいけないというのが鉄則で,しかもターゲットが比較的小さい集団なので,場所を決める+キープするのがとても難しい.なので可能ならば初めの1回でそれなりに大きめの検体を取りたいところです.その点,Cryoprobeを使用するのはかなり理にかなっていると言えます.
このERBEのUltrathin cryoprobeは太GSのK-203ならば採取後GSを留置したままプローブを引き抜けるようです(K-201の細GSだと,GSごと引き抜く必要ありと記載あります).GSには止血目的に留置できますので,GSを使用するならばK-203を使用した方が引き抜き後に出血で慌てることは少ないような気がします.ただしこの出血のイベントについてはもう少し症例を集めてから議論が必要と思います.しかしながら,K-203を使用するとなると必然的にスコープ径は大きくなりますので,今度はGGNそのものへのアプローチ能が落ちるということになります.このジレンマは致し方ないですが,よりPeripheralにある結節ではさすがに1Tスコープで簡単に気管支を選択するのは難しいでしょう.症例を選ばないとこの組み合わせは難しそうです.アプローチという点では,MP scopeと合わせて使用するのが理にかなっているような気がしますが,1.7mmのWorking channelではスコープを留置したままの検体の引き抜きができないかもしれませんね.ここもジレンマ・・・
このUltrathin cryoprobeにあわせて,外径が細くて(末梢へのアプローチ性),Working channelが大きい(スコープ留置したまま検体が引き抜ける,安全)スコープがあればベストですが,ニーズがニッチすぎますかね.
では

新しい明日へ!
データベース入力・管理 TNM分類 c?p?yc?yp?
今日も今日とてデータベースを管理するReviewer2です.
皆さん,データベース,”きちんと” 入力してますか?
症例のデータベースは各施設独自のものを使用していると思いますし,疾患や領域によって入力項目がかなり違うでしょう.
癌の症例を組み込んでいる人は,ステージを入力すると思いますが,リサーチによっては術前治療の有無も考慮したり,Re-stageの情報を入れることもありますよね.
TNM分類ですが,いつのバージョンに準拠しているのか明確に定義しないと後で混乱がおきます.いつから第8版をもとに入力している,などデータベースを入力する人,使用する人は必ず知れるように,私はデータベース(Excel)の別タブに定義を貼っています.
それから,Clinical TNMなのかPathological TNMなのか,これがリサーチによっては区別必要なこともあります.
Clinical staging ならば cTxNxMx
Pathological stagingならば pTxNxMx
と入力します.
また術前治療がある場合には それぞれの前に ”y” をつけます.
Neo-adjuvant therapy後のClinical stagingならば ycTxNxMx
Neo-adjuvant therapy後のPathological stagingならば ypTxNxMx

↑データベースから抜粋 こんな感じ.T,N,Mはそれぞれわけて入力してます.
もちろん入力はDropdown listを使用.自動で第8版のStageがでるようにしてあります.エクセル関数で,おそらくもっともっといい関数あると思うのですが,とりあえず作ったもので十分なので,以下のような式で第8版はいけます.(上の図でいうK2のセルに入れるものです)
=IF(OR(E2="Ad", E2="Sq", E2="AdSq", E2="La", E2="NSCLC", E2="Sm", E2="LCNEC", E2="carcinoid"), IF(OR(H2="M1a",H2="M1b"),"IVA",IF(H2="M1c","IVB",IF(AND(G2="N3",OR(F2="T4",F2="T3")),"IIIC",IF(G2="N3","IIIB",IF(AND(G2="N2",OR(F2="T3",F2="T4")),"IIIB",IF(G2="N2","IIIA",IF(F2="T4","IIIA",IF(AND(F2="T3",G2="N1"),"IIIA",IF(F2="T3","IIB",IF(G2="N1","IIB",IF(F2="T2b","IIA",IF(F2="T2a","IB",IF(F2="T1c","IA3",IF(F2="T1b","IA2",IF(OR(F2="T1a",F2="T1mi"),"IA1",IF(F2="Tis",0,"Unknown")))))))))))))))), "")
データベースはまだまだ続きます.

新しい明日へ!
Franseen needle
針の分野ではわりと新しい風が吹いている.内視鏡用のFranseen needle.
今回の論文は,

J Am Soc Cytopathol. Jul-Aug 2020;9(4):249-253. doi: 10.1016/j.jasc.2020.04.009. Epub 2020 Apr 28. Core needle biopsy with endobronchial ultrasonography: single center experience with 100 cases
ユタ大学.
内視鏡用のFranseen needleのエビデンスはEUS-FNAでは集まってきています(Endosc Ultrasound. Mar-Apr 2019;8(2):99-104. doi: 10.4103/eus.eus_53_17. / Clin Endosc. 2018 Nov;51(6):576-583. doi: 10.5946/ce.2018.053. Epub 2018 Jul 13.).それをEBUSに応用しようというのは世の流れ.
Franseen needleはこんな感じ,ミツマタとか呼んでいる人もいます.
 (同論文より引用)
(同論文より引用)
今回のStudyはBoston ScientificからのAcquire needleを使用しています.22Gと25Gのラインナップ.
通常の22Gで採取する検体をたとえCell blockを作成したとしてもそれをCore tissueと呼んでよいのかという議論が長らくあって,そこで出てきたのがこの種の針デバイス.この論文の中でも,EBUS-TBNAではなく,EBUS-TBNBという言い方をしており,AspirationではなくBiopsyなんだ!というのを強調しています.彼らは検体をCore tissueと呼んでいます.
22 of 23の高い診断率でGranulomatous inflammationの診断がつけられたということを強調しています.
[感想]
これまでのEBUS-TBNAで悪性の診断は高い精度で得られるので,このFranseen needleがルーチンに使われるということはあまり考えられません.この論文が言うように,肉芽腫病変を疑うようなリンパ節,もしくは大きめの検体,Coreが欲しいようなLymphomaに応用するのがよいような印象です.
デバイスはBoston(https://www.bostonscientific.com/en-US/products/needles/acquire-pulmonary-fine-needle-biopsy-device.html)と,Medi-globe(SonoTip TopGain)(https://www.sonotip.de/en/home-en#ebus).これからいくつかEBUS-TBNBの臨床試験結果がでてくることでしょう.
ただ,その針の固さとかアクセス性についてはまだ情報が乏しいです.
Targeted Lung Denervation (AIRFLOW-2 trial)
Targeted Lung Denervation, 略してTLD
COPDに対するBronchoscopic interventionのひとつです.太めの気管支周囲にある副交感神経を焼く治療です.なのでその他のinterventionであるバルブやコイルとはコンセプトがそもそも異なります.
今回は,この論文の紹介

Int J Chron Obstruct Pulmon Dis. 2020 Nov 5;15:2807-2816. doi: 10.2147/COPD.S267409. eCollection 2020.
Two-Year Outcomes for the Double-Blind, Randomized, Sham-Controlled Study of Targeted Lung Denervation in Patients with Moderate to Severe COPD: AIRFLOW-2
AIRFLOW-2試験,ヨーロッパグループですが,アメリカが混じっています.
Blue Journalにのった論文(Am J Respir Crit Care Med. 2019 Dec 15;200(12):1477-1486. doi: 10.1164/rccm.201903-0624OC.)の2年フォローアップの内容です.
1:1のランダム割付,治療群 VS Sham群です.Sham群は同じ様に気管支鏡を入れてデバイスも接着させますが,電流は流れないという仕様です.この手の試験ではこのSham群がおけるので科学的妥当性は担保されます(日本ではやりにくそうな試験ですが).しかもDouble blind.術者も治療群なのかコントロールなのかわかりません.これが高熱量のRFAの治療なんかだと,治療群がはっきりわかってしまうのでSham群はおけないわけです.
41人と41人にランダム割付されています.417日後からクロスオーバーが許されています.Sham群の患者がTLDをうけてよいことになっています.
Primary outcomeは12.5か月後までのSevere COPD exacerbationのTime to event (Log rank)で,HR 0.379, 95%CI 0.145-0.993, p=0.0394 (これはAJRCCMの先の論文の内容と同じ)
2年Follow-upまでのModerate and severe COPD exacerbationは,HR 0.705, 95%CI 0.423-1.177, p=0.1825
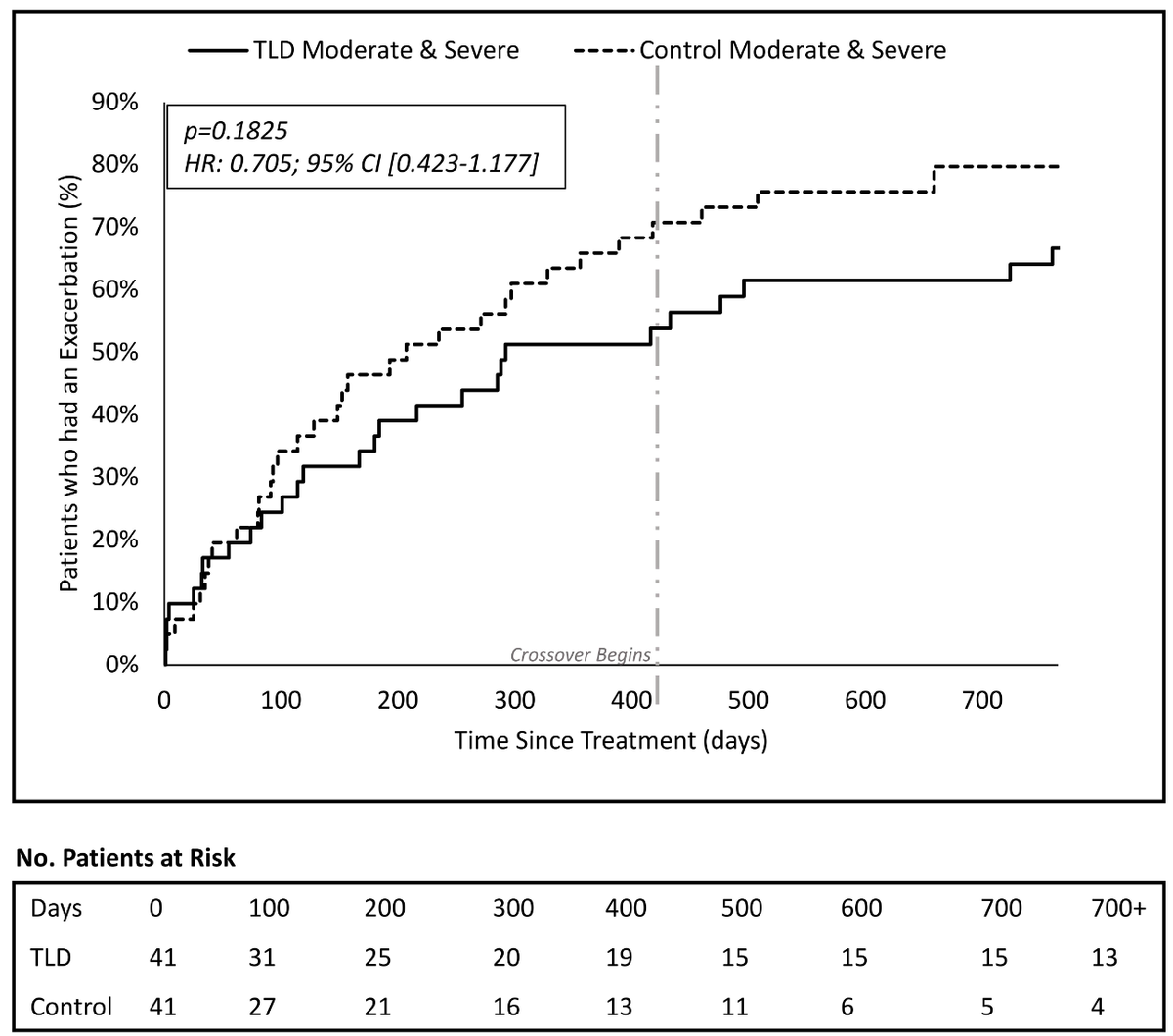
[感想]
TLDの発想は面白いが,Clinical impactがどこまであるのかがよくわからない.もう少しエビデンスが必要と思います.
AJRCCMの方の論文では,施行後3-6.5か月までのRespiratory event(Any grade)の率で比較していて70.7% vs 31.7% (p=0.0008)でTLDの方がよいという結論なのですが,この差を体感できるほどのQOLの差がでるのか,というのが疑問が残ります.
今回紹介の論文では2年フォローでModerate+SevereのCOPD増悪には有意差が示されなかったわけですが,途中でSham群の41人中20人がクロスオーバーしているのがまた解釈に困りますね.
いずれにしてもNが少ないので,これからの症例集積に期待ですね.
EBUS-TBNAの鎮静薬 Dexmedetomidineがいい?
今日はこの論文
Eur J Anaesthesiol. 2020 Oct 28. doi: 10.1097/EJA.0000000000001370. Online ahead of print.
Dexmedetomidine versus midazolam for sedation during endobronchial ultrasound-guided transbronchial needle aspiration: A randomised controlled trial
Junghyun Kim, Sun Mi Choi, Young Sik Park, Chang-Hoon Lee, Sang-Min Lee, Chul-Gyu Yoo, Young Whan Kim, Jinwoo Lee
韓国から,単施設ですがA randomised, double-blinded trial.試験デザインを含めてもっと評価されていいような気がしますが.
EBUS-TBNA102症例をランダム割付(DEX群 48,MDZ群,54)
両群ともにMDZの追加投与があったので,厳密にはDEX±MDZ VS MDZ の試験
結果として,Desaturation, MDZ追加投与量,鎮静レベル,sedation satisfaction scoresは同程度.しかしCough scoreがDEX群で有意に低かった.
DEXはhighly selective α2-adrenergic receptor (α2-AR) agonist で呼吸抑制が少ないとされているので,この試験もPrimary outcomeはOxygen desturationに設定されていましたが,有意差なしの結果.
とはいえ,Double-blindの試験をしっかり組んだので,この試験は評価されるべきだと思います.個人的には,Dexmedetomidineによる徐脈をいくつか経験したことから,気になってしまいます.
[ADVANCED REVIEW]

もう一つ参考程度にEBUS-TBNAの鎮静関連でこの論文,
Anesth Analg. 2019 Jan;128(1):98-106. doi: 10.1213/ANE.0000000000003633.
Dexmedetomidine Versus Remifentanil for Monitored Anesthesia Care During Endobronchial Ultrasound-Guided Transbronchial Needle Aspiration: A Randomized Controlled Trial
Patrick St-Pierre, Issam Tanoubi, Olivier Verdonck, Louis-Philippe Fortier, Philippe Richebé, Isabelle Côté, Christian Loubert, Pierre Drolet
カナダ,モントリオールから.
EBUS-TBNAにおける鎮静,DexmedetomidineとRemifentanilのランダム割付.
結果,Dexmedetomidineの方が,有意に呼吸抑制イベント(低呼吸,無呼吸,desaturation)が少なかった.しかし,Remifentanilに比べると,postanesthesia care unitからの退室に時間がかかった.これは醒めの悪さを意味します.
結局のところ,その施設のやりやすい薬剤を選択するという形になると思います.
麻酔チームがいるのかいないのか,鎮静度や呼吸状態を観察する人員はきちんといるのかいないのか,こういったファクターの方が大きいので,なかなかこの領域でベストな鎮静薬の組み合わせとかを議論するのは難しくなります.