EBUSガイド下リンパ節内鉗子生検(EBUS-IFB)[手技のフローとして組み込む,ROSEがnegativeのとき]
前回の投稿に引き続いて,同じEBUS-IFBの話題
EBUS-IFBの効果,役割が今後のエビデンスのさらなる蓄積で明らかになったとしても,それを臨床のどこに位置付ければよいのかを考えておかないといけない.すべての症例でEBUS-IFBを行うというのは時間的にロスが多すぎる.それほどEBUS-TBNAの手技が早いということでもある.
今回は少し前の論文を紹介.ここではIFBではなくTBFBと略していますが,呼び名はあまり気にしなくてよいと思います.
Clin Respir J. 2020 Apr;14(4):314-319. doi: 10.1111/crj.13133. Epub 2019 Dec 27.
Endobronchial ultrasound-guided mediastinal lymph node forceps biopsy in patients with negative rapid-on-site-evaluation: A new step in the diagnostic algorithm
迅速細胞診(ROSE)を併用したときにROSEの結果がnegativeのもののうち,追加で行ったEBUS-IFBによって診断が得られていたものは全体の27%であった(8/30)という結果です.
ROSEがnegativeのとき,というのがミソだと個人的には思っています.
つまり,診断しにくそうな相手を始めからEBUS-IFB,とするのではなく,そこにROSEを介すことでコスト的にも安全性的にもプラスに働かせるというStrategyです.もちろん,この論文の内容を批判的に見ると,ROSEはその判断者の力量に大きく依存してしまうので,すべての施設に当てはまるとは言えない,という議論もできます.しかしながら,ROSEを介することで,そこで明らかにpositiveなものは,EBUS-TBNAで続けて検体量さえ採取できればそれでよいのです.
前回紹介したmeta解析の論文で示されているように,EBUS-TBNAと比べてEBUS-IFBは合併症が若干増える.そして技術が要るので行う施設も限られる.だからこそ日常臨床でむやみに(例えば全例に)行う手技ではないと言えます.
検査前確率が高いにも関わらずROSEでnegativeであれば,IFBを検討すればよいのでは,というフローは理にかなっていると思います.
もちろん,ROSEを導入できる施設も限られてはいますが,ROSEはそれほどのインパクトをもつとも言えます.
以上の議論は,「診断」についての話です.診断さえつけばよいというのであれば,そのフローでOK.しかし問題は「検体量」が問題のときです.たとえばLymphoma.そのサブタイプ解析まで必要,というときに量が求められます.EBUS-TBNAで明らかに十分な量が採れているというのであれば問題はありませんが,そうでない場合(明らかに十分な量採れていると自信を持って言えることは少ない)はIFBも考慮に入れてもよいかもしれません.
ここのところの「量」(もちろん質を保った「量」)に関する比較研究が出てくるのが期待されます.

新しい明日へ!
EBUSガイド下リンパ節内鉗子生検(EBUS-IFB)[EBUS-TBNAへの追加効果]
EBUSガイド下リンパ節内鉗子生検(EBUS-IFB)はこれまでに報告が蓄積しています.最近出たCoreDXに関連して始まった手技ではないです.
EBUS-TBNAで検体量が少ないというのであれば,生検鉗子をつっこんで採取してしまおうという発想.手技自体はこの動画を見た方がイメージがつきやすいかも.
今回は,そのMeta-analysisです.
Ann Thorac Surg. 2021 Jan 21;S0003-4975(21)00103-X. doi:10.1016/j.athoracsur.2020.12.049. Online ahead of print.
Combined EBUS-IFB and EBUS-TBNA vs EBUS-TBNA alone for intrathoracic adenopathy: A Meta-analysis
最終的に6つのStudyだけ採用して解析しています.
診断率の比較(EBUS-TBNA VS EBUS-TBNA+EBUS-IFB)
サルコイドーシス: 58% (93-161) VS 93% (150/161), P<0.00001
リンパ腫: 30% (15/50) VS 86% (43/50), P=0.003
全体: 67% (312/467) VS 92% (428/467), P<0.00001
結論として,EBUS-IFBの追加が,サルコイドーシス,リンパ腫の診断を向上させる.合併症については,1%で縦隔気腫,0.8%で出血が認められた.
これまでにEBUS-IFBのメタ解析はなかったと思うので,エビデンスがそれなりに揃ってきたということになります.特にリンパ腫の診断ではその効果を大きく発揮するものと思います.サルコイドーシスについては,EBUS-TBNA単独群の診断率が低いなという印象です.
注意しなければいけないのは,論文内でLimitationに書かれているように,IFBに用いる生検鉗子のサイズは統一されていないということです.また,追加で採取するのだから,診断率は向上する方向に働くのは当然で,採取回数やリンパ節のサイズなどもある程度そろえないと単純に解釈はできません.
もし試験を組むなら,前向きで,使用デバイスを揃えて,EBUS-TBNA単独 VS EBUS-IFB単独 でやるか,EBUS-TBNA+EBUS-TBNA VS EBUS-TBNA +EBUS-IFBで施行回数を統一するかかなと思います.
いずれにしてもIFBはそれなりに技術を要します.技術的に卓越した施設で行われる手技だと思います.特に粘膜に穴をあける位置の決定や,穴をあけた後の鉗子の力の加え方は,間違えると血管を傷つけてしまう可能性もあります.今回のメタ解析の合併症は技術的に卓越した施設からの報告をまとめた数字(低いということ)であることを含めて考えた方がよいでしょう.
このEBUS-IFBの手技がもっと広がるかどうかは未知数ですが.リンパ腫診断のためのオプションとして頭には入れておいた方がよさそうです.

新しい明日へ!
Metered cryospray [COPDのインターベンションとなりえるか]
COPDの薬剤抵抗性の患者さんは世界にたくさんいます.
そのニーズにあわせてCOPDに対するインターベンションがどんどん出てきています.
Metered cryospray

Eur Respir Rev. 2021 Jan 19;30(159):200281. doi: 10.1183/16000617.0281-2020. より引用
今までの残気量を減らすというアプローチ(バルブ,コイル)ではなく,気管支粘膜に直接働きかけるタイプのもの.Targeted lung denervationは神経を焼くというコンセプトでしたが,こちらは凍結させて粘膜細胞を一掃するというもの.
使うのは液体窒素(LN2)です.決められた量のLN2がスプレー状に散布されるデバイスでGoblet cellを中心とした粘液分泌性の細胞の増生をリセットして,正常粘膜細胞に置き換えるというコンセプトと言われています.
効果,コンセプトはさておき,そんなことして大丈夫なのか?という安全性に主眼をおいたStudyが以下.
Eur Respir J. 2020 Dec 17;56(6):2000556. doi: 10.1183/13993003.00556-2020.
A prospective safety and feasibility study of metered cryospray for patients with chronic bronchitis in COPD
前向きオープンラベル試験.計35例に施行.
施行後12か月間で,11例で14のSeriousな有害事象が生じ,COPD急性増悪x6,肺炎x2を含む,のべ9回の呼吸器関連有害事象.手技そのものに関連したSeriousな有害事象はなかったとされる.
効果については,施行後3か月時点でSGRQ(-6.4),CAT(-3.8),LCQ(21.6)と有意に改善を認めた.
今後,Sham群をコントロールとした前向き試験の結果を待つことになると思いますが,Double blindにできないところはLimitationになるでしょう.
またもちろん考察でも触れられていますが,その効果の持続期間が議論のひとつになるでしょう.3回にわけて施行するそれなりに医療資源もつぎ込む治療ですので,数か月でもとに戻る,というのでは患者さんにもなかなか勧められないでしょう.

新しい明日へ!
肺野結節マーキングとしてのAugmented fluoroscopy [臨床に即した工夫]
以前にもAugmented fluoroscopyについては触れたが,
今回の論文は,肺野末梢結節手術のためのマーキング技術としてAugmented fluoroscopyを使用したもの.
論文の内容そのものに新規性は少ないものの,臨床の場面でどういった工夫がなされ,その施設でどのような紆余曲折を経て,技術を習得,安定化させていったのかがよくわかるような内容である.
この種の論文は非常に参考になる.実際にどのくらい手技に時間がかかって,どれくらいの不成功例があるのか,など.その施設のDrに尋ねたいことを惜しげもなく載せている.
例えば,
「被ばく量を考慮して,16例目からSmall sizeのField of viewのDynaCT scanに変更した.23例目からは散布色素に造影剤を混ぜて使用した.65例目からは仰臥位ではなく側臥位での手技に変更した.」など,論文に必ずしも載せなくてもよい工夫が書いてある.こういう情報は臨床医にとっては非常に参考になる情報で,どうして仰臥位よりも側臥位がよいのか,について考えるきっかけになる.(実際に側臥位にした方がよい根拠論文も引用している).
施行した100症例をしっかりとSummarizeしたのは素晴らしいし,手技が安定してきた実際の臨床に即したデータを知れるのがよい.色素散布手技のみに限っては気管支鏡施行時間が平均8.3分.案外早いんだなという印象.
肺結節のマーキングは,位置だけ特定してその近辺に色素やマーカーを置いてくればよい,という単純なものではない.この論文の中で触れている通り,素直に枝が到達する結節ばかりではなく,そのような場合には,結節を囲んだ形でマーキングしなくてはならないし,色素とコイル留置を組み合わせて,場所を立体的に把握する工夫もしている.
VAL-MAPを施行している施設も増えてきているとは聞くが,マーキングをより正確に,安全に,早く施行するための補助技術はまだまだ出てくるものと思われる.

新しい明日へ!
EBUS画像スコアリング [臨床に落とし込むことで活きる]
Chest. 2021 Jan 9;S0012-3692(21)00027-1. doi: 10.1016/j.chest.2020.12.050. Online ahead of print.
Endobronchial Ultrasound Staging of Operable NSCLC: Do Triple Normal Lymph Nodes Require Routine Biopsy?
カナダの他施設グループから.
以前から,このCanada lymph node score (CLNS)の発表は学会で見ていましたが,これを臨床に応用した点は高く評価できます.
cN0の症例のうち,リンパ節が,1) CTでShort axis <1cm,AND 2) PETでNo hypermetabolic activity, AND 3) CLNS <2 となったものをTriple negative lympn nodeとして名付けて定義しています.ネーミングはともかくとして,このTriple negative lymph nodeをBiopsyする必要がないのではないか,というのがClinical question.
CLNSはMargins, Central Hilar Structure, Central Necrosis, Small Axis diameterの4つの因子でスコアリングします.
結果,Negative predictive valueは93.1%.
結論として,Triple negativeをBiopsyする必要がないとは断言していませんが,Nを増やして前向き試験をやっていくということで締めくくられています.
・考察
すこし掘り下げますが,ご存知の通りかなり前から,EBUS画像で見られるリンパ節の特徴を分類し,悪性・良性の検査前確率が論じられてきました.一番有名なのは,Fujiwara et al. Chest. 2010 Sep;138(3):641-7. doi: 10.1378/chest.09-2006.の論文でしょう.そこからもいくつか悪性リンパ節を予測する特徴やスコアリングの論文が出てきました.
しかし,欠点もあります.それはエコー画像の白黒画面を観察者が見て,それを分類しているということです.これは観察者内で統一した見解がないと,大きく所見がぶれてしまいます.どのくらいの所見をCentral Necrosis有りととるのか,Central hilar structureの有無は,静止画一枚だけでは難しく,きちんとリンパ節全体をEBUSで観察した動画でないと見落とすこともあります.上記論文内では,観察者間でのスコアリングの一致率や,観察者内でのブレも一応結果は載せていますが.
この論文,CHESTに載るには,Nが少ないのでは?と思った方もいらっしゃるでしょう.私はこの論文のインパクトはもっと違う観点でとらえた方がよいと思います.それは,異なるモダリティの組み合わせによる検査前確率を実臨床の行動決定に大きく関わるところにClinical questionを置いたところにあると思います.採取するのかしないのか,です.
今までリンパ節の悪性・良性を推定する話(Optical biopsy)は,「でも結局病理検体採取するんでしょ,なら要らないじゃない」とよく言われていました.つまり,採取直前に見たEBUS画像を解析したところで,結局そのあと検体を採取するのであれば,解析しようがしまいが,EBUS-TBNAの診断能は高いので,意味がないだろうという論点です.確かに一理あるところですが,もし仮にその採取をスキップできたら,患者の安全・苦痛度は良くなりますし,医療資源の浪費削減につながります.
今回の結果だけでは,採取をしなくてよいという結論にはならないでしょう.143のリンパ節のうち8個(5.6%)が悪性であったこの数値をどう見るかですね.

新しい明日へ!
EBUS-TBNA針の比較 ProCore VS Vizishot [その比較の意味は?]
針の比較の論文
Expert Rev Med Devices. 2021 Jan 12. doi: 10.1080/17434440.2021.1876560.
Diagnostic yield and safety of the ProCore versus the standard EBUS-TBNA needle in subjects with suspected sarcoidosis
サルコイドーシスを対象に100例をランダムに,Cook medical社EchoTip-ProCore 22GとOlympus社Vizishot 22Gに割付したもの.
有意差示されず.ProCore (36/42, 85.7%) VS Vizishot (31/42, 73.8%), (p=0.18).
ProCoreは感覚的に検体がよく取れるような印象はありますが,凝血槐も一緒に含まれている場合が多いような感じはあります.
この論文の方法や結果解釈はさておき,そもそも同じMethodの中で他社の針を比較する意味は何なのでしょうか?
同社で従来品と進化版を比較するのはなんとなく意味はわかる(改善結果を評価したい).しかし,他社のEBUS-TBNA針同士を比較することにどれくらいの臨床のインパクトがあるのでしょうか.針が劇的に形態を変えたというのであれば,比較してもよいと思いますが,ここでいうProCoreとVizishotの違いは切り欠きの部分です.針の固さもハンドルパートも違う.これを比較しても解釈に困ります.
違うMethodを比較するのはもちろんアリだと思います.しかし同じEBUS-TBNAという行為です.大きく変わらない方法で,その針というデバイスの違いだけ比較するのは,あまりインパクトがありません.そもそもそこまで差が期待できない.その差を検討するのにNがたくさん必要.
他社製品に勝った負けたは,企業にとっては大きな問題でしょうけれども,その違いが患者さんへの利益の差につながるのかというのをもう少し考えて臨床試験を組むべきだといつも自分に言い聞かせています.
他社製品どうしの比較をする臨床試験は,その差は何を意味するのかをふまえて,やるべきかどうかを考えたいですね.

新しい明日へ!
Flip-flop fungus sign[手がかりとしてはいいかも?]
Flip-flop fungus sign
Am J Nucl Med Mol Imaging. 2017 Nov 1;7(5):212-217.
The flip-flop fungus sign: an FDG PET/CT sign of benignity
Mayo clinicから
PET/CTから原因疾患を推測する,このアプローチ自体は面白い.知っておいてよいかもしれない.真菌感染をルールアウトする,というオプションが思いつける.しかし,これを見たから生検検査をスキップしてよいか,というのはまた別の問題かと.
この論文の中では,Flip-flop signを以下のように定義しています.
Flip-flop fungus sign criteria
At least 1 pulmonary nodule is present Solid or part solid (not ground glass)
8-30 mm mean diameter
Not necrotic, invasive, or calcified
Any level of FDG activity
At least 1 FDG-avid draining lymph node is present
SUVmax node > mediastinal blood pool
Station 11 (ipsilateral), 4 (ipsilateral) or 7
At least 1 draining lymph node has ≥ SUVmax than the pulmonary nodule(s)
Absence of FDG avid lesions worrisome for cancer
No obvious extrathoracic malignancy
FDG avid lesions in reticuloenthelial system (lymph nodes, spleen, liver) permitted
Strict Exclusion Criteria
Presence of calcified pulmonary nodule(s)
Indicating prior exposure and possible immunity
Nodule(s) is/are part-solid and stable, slowly growing, or slowly becoming more dense (even if shrinking) over more than 1 month
More likely to be neoplastic
Nodule(s) is/are solid and growing for more than 1 month
More likely to be neoplastic
Nodule(s) is/are solid and stable for more than 1 year
More likely to be an old granuloma unrelated to FDG avid lymph node
Presence of pathologic FDG avid lesions outside of the thorax (including nodes, spleen, liver)
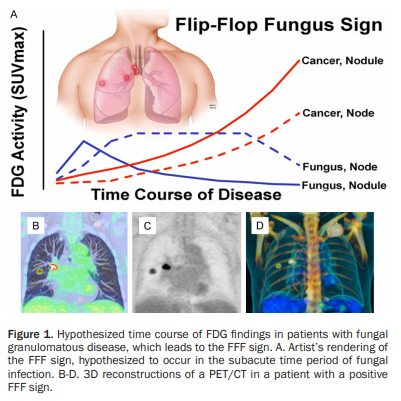

このSignの定義はややこしいですが,肺野病変よりもリンパ節でのFDG集積が高くなるということです.しかし,問題はこれを見たからといって悪性を否定できるのかといいうことです.リンパ節生検をスキップして経過観察にもっていくにはなかなか勇気がいります.
足りない情報はこのSignがどれだけ適中するのかというデータです.多い症例数をすべて前向きに検討したstudyはないので,このSignを実臨床に組み込むにはまだエビデンス不足(2020年現在)と言えるでしょう.
しかし,このSignを知っておいて損はありません,検査で悪性が否定された場合,真菌は見落としていないか?という意識がはたらく,という意味では有用だと思います.

新しい明日へ!